Así lo señalan los académicos en su paper titulado “Pneumocystis jirovecii is a potential pivotal ecological driver contributing to shifts in microbial equilibrium during the early-life lower airway microbiome assembly”, recientemente publicado en Communications Biology, una revista de acceso abierto del grupo Nature Portfolio. Según explica el doctor Magne, “es el primer estudio que caracteriza la microbiota en el pulmón de sujetos aparentemente sanos”. Esto fue posible gracias al análisis de muestras directas de tejido pulmonar obtenidas durante autopsias, que permiten evitar la contaminación con bacterias de las vías respiratorias superiores, lo que representa una ventaja clave frente a otras técnicas más invasivas o menos precisas.
“Aún hay muchas interrogantes respecto de la microbiota pulmonar. Hace unos diez años se descubrió que los pulmones no son estériles, como se creía antes, sino que también albergan microorganismos”, explica el académico. El desafío fue entender de dónde provienen. Algunos vienen de las vías respiratorias y seguramente del medioambiente, pero suelen ser pasajeros, ya que el cuerpo los elimina rápidamente. Entonces surgió una nueva pregunta: ¿existen microorganismos capaces de establecerse en el pulmón, como ocurre en el intestino o en la boca? Para responder a eso, junto con el doctor Vargas unimos fuerzas en nuestras investigaciones, con el objetivo de identificar esos microorganismos, entender cómo interactúan y qué rol cumplen en nuestra salud.” Para esto fue clave la colaboración de Carolina Ponce que tiene años de experiencia trabajando en Pneumocystis.
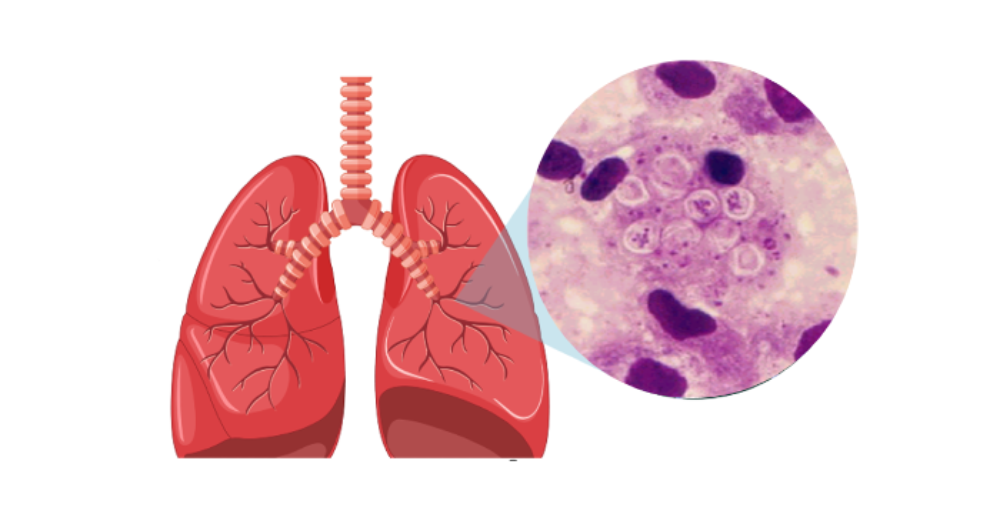
El estudio investigó la colonización fúngica y bacteriana en las vías respiratorias inferiores durante el primer año de vida. Para ello, se utilizaron muestras de tejido pulmonar obtenidas en autopsias de 53 lactantes aparentemente sanos que fallecieron de forma súbita. Las comunidades microbianas presentes en esos pulmones fueron caracterizadas mediante técnicas avanzadas de secuenciación genética, que permiten identificar tanto hongos como bacterias a partir de fragmentos específicos de su ADN.
“Nuestra investigación destaca un alto grado de variabilidad entre un lactante y otro en cuanto a los hongos y bacterias que habitan en sus pulmones” señala la publicación. “En general la microbiota del tracto respiratorio inferior se compone principalmente de microorganismos transitorios, que probablemente viajan desde el tracto respiratorio superior y no se establecen allí permanentemente. Sin embargo, también podrían existir ciertos microorganismos capaces de establecerse de forma más duradera, lo que podría tener efectos en la fisiología o enfermedad pulmonar. Además, entre los tres y cuatro meses de edad, se observaron importantes cambios en estas comunidades microbianas, lo que sugiere que ese período podría ser una etapa clave en la maduración del microbioma pulmonar.”
De esta forma, el doctor Magne explica que, “por primera vez logramos caracterizar la microbiota de pulmones sanos en humanos, y descubrimos una gran diversidad de hongos y bacterias. Sin embargo, también vimos que solo algunos microorganismos estaban presentes con frecuencia y en altas concentraciones: cinco tipos de hongos y nueve de bacterias, lo que sugiere que podrían ser colonizadores habituales del pulmón”. Además, mediante modelización, el equipo logró determinar cómo ocurre este proceso de colonización en la etapa temprana de la vida. “Extrapolando nuestros datos, reconstruimos la secuencia temporal, y nos dimos cuenta que entre los dos y los cuatro meses de edad se produce un cambio importante en la composición de la microbioma, coincidiendo con un aumento de la prevalencia y abundancia de Pneumocystis. Más del 80% de los lactantes de esta edad estaban colonizados con este hongo, lo que sugiere que podría tener un rol clave en la formación y desarrollo del ecosistema microbiano pulmonar”.
Importante ventana de tiempo
Respecto de las posibles consecuencias para la salud pulmonar de estos hallazgos sobre Pneumocystis, el doctor Sergio Vargas explica que, basándose en sus investigaciones sobre esta infección, ha encontrado que “este hongo es más frecuente entre los 2 y 5 meses de edad, y su sola presencia activa la respuesta inmune innata del hospedero, lo que provoca una gran secreción de moco, lo que constituye patología pulmonar. El doctor Vargas agrega que “El significado clínico de estos cambios es muy claro: la epidemiología demuestra que la presencia de Pneumocystis entre los dos y los cuatro meses coincide con una mayor incidencia de hospitalizaciones en niños, debido a cuadros virales de mayor severidad, como el virus sincicial, metapneumovirus y otros virus que afectan al pulmón”.
“Los cambios que observamos en el microbioma y en la respuesta inmune generan un estado de mayor reactividad pulmonar, lo que puedehacer que las infecciones sean mas severas. Esto lo planteamos en una hipótesis llamada “double hit” hipótesis, bajo la idea que dos golpes son más fuertes que uno. Es decir, el cuerpo puede manejar una infección por sí solo, pero es más difícil cuando hay dos. Por ejemplo, una infección por el virus respiratorio sincicial puede ser grave, pero aún más grave si ocurre como co-infección durante la ventana de tiempo en que Pneumocystis está presente en el pulmón. En estudios previos hemos demostrado una tasa de positividad superior al 90% para este hongo, usando técnicas muy sensibles. Ahora, esta investigación sobre microbiomas respaldan esta hipótesis, ya que mostraría la relevancia de suprimir esta infección para reducir la gravedad de los cuadros respiratorios por otros virus”.
En ese sentido, aunque investigaciones previas de su equipo demuestran que la infección por Pneumocystis no es la causa directa de la muerte súbita en lactantes, parece ser un factor necesario que contribuye en este proceso como adyuvante. “Esto se relaciona con lo que señala el doctor Magne: no se sabe si la infección por Pneumocystis va a favorecer o no al paciente, porque aunque al activar fuertemente la respuesta inmune innata se estimula la producción de moco lo que podría ayudar a eliminar virus como el de influenza; pero si esa producción de moco es excesiva, puede llevar a un colapso brusco de la vía aérea”. El aumento de las glicoproteínas que componen el moco podría también explicar el crecimiento de bacterias que lo utilizan como nutriente.
El doctor Magne concluye destacando que además, “es importante entender que estos microorganismos que comienzan a colonizarnos desde etapas muy tempranas de la vida pueden tener un impacto significativo en nuestra salud, con efectos que incluso podrían manifestarse en la adultez”.
Este estudio forma parte del proyecto de la Unión Europea titulado "Recognition of the primary infection by Pneumocystis in infants: a silent threat to public health" (ELAC2014/HID-0254), liderado por el doctor Sergio Vargas. Tal como señala, “este proyecto representa la consolidación de una colaboración de más de diez años con destacados investigadores de la Unión Europea, como el doctor Enrique Calderón, de la Universidad de Sevilla, y el doctor Andrés Moya, de la Universidad de Valencia, centrada en comprender el papel de Pneumocystis en la salud respiratoria infantil”.
En esta fase del proyecto se integró el doctor Fabien Magne, recientemente incorporado al Programa de Microbiología del Instituto de Ciencias Biomédicas, quien aportó su experiencia en el estudio del microbioma. “Los resultados obtenidos no solo reforzaron las hipótesis del equipo, sino que también fueron fundamentales para la adjudicación de tres proyectos Fondecyt Regular, que actualmente profundizan en el impacto de las infecciones tempranas por Pneumocystis y su relación con la salud respiratoria a lo largo de la vida”, finaliza el doctor Vargas.