El profesor Julio Tapia, director del Laboratorio de Transformación Celular del Programa de Biología Celular y Molecular del Instituto de Ciencias Biomédicas, explica en primer término que el cáncer en sí no es lo que termina con la vida de los pacientes, sino que es su agresividad el verdadero problema, pues se hace resistente a las terapias y coloniza otros órganos distintos del sitio en que se originó; es decir, la metástasis. Este es un tema de vanguardia en la investigación en cáncer, donde se buscan marcadores específicos para determinarla, los que podrían servir a su vez como indicadores de mal pronóstico o incluso como nuevos blancos de terapia.
¿Y si hubiera alguna forma de controlar esa agresividad? Las líneas de investigación desarrolladas por el profesor Tapia y su equipo se han centrado en el estudio de la proteína kinasa CK2 y su vinculación con diferentes tipos de cáncer. Esta es una enzima altamente conservada y presente en todas las células eucariotas estudiadas hasta el momento; su función es fosforilar – es decir, agregar una molécula conocida como fosfato - a más de 300 proteínas dentro de la célula, lo que la involucra en numerosos procesos, tales como expresión de genes, síntesis de proteínas, división, desarrollo o muerte celular. Por ello, ha sido implicada en varias patologías que incluyen enfermedades infecciosas, degenerativas y, por supuesto, el cáncer.
“En investigaciones previas en un modelo in vitro de cáncer de colon junto a mi tesista de doctorado Ignacio Niechi, actualmente académico de la Universidad Austral de Chile, encontramos que cuando CK2 fosforila a la enzima convertidora de endotelina-1c (ECE1c), hace que esta no se degrade; por lo tanto, extiende por mucho su estabilidad y su vida útil. Pero, además, demostramos que esta mayor estabilidad se relaciona con un incremento de la agresividad, porque las células de cáncer de colon se hacen mucho más invasivas y también más resistentes a los quimioterapéuticos que habitualmente las matan”.
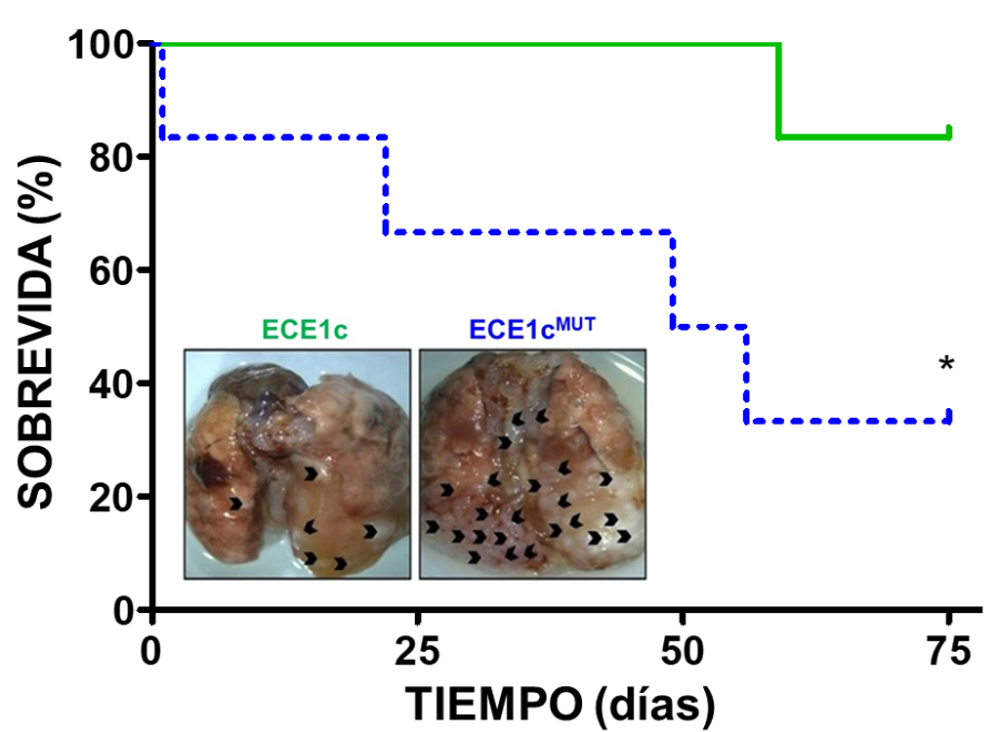
Otro miembro de su equipo, el tesista de doctorado Pablo Pérez, encontró que cerca de donde se produce esta fosforilación en ECE1c hay un aminoácido, la lisina –responsable de su degradación- que si se muta por una arginina se vuelve súper estable y, si esta proteína mutante se expresaba en células de cáncer de colon, estas se hacían más metastásicas y formadoras de tumores grandes en un modelo preclínico animal: es decir, se vuelven mucho más agresivas.
Aparte de lo novedoso de esos hallazgos, otro hecho crucial en la investigación fue que la mayor agresividad de las células se debía a que estas habían adquirido cualidades de células troncales cancerosas (o Cancer Stem Cells en inglés), “que ahora se sabe son las responsables de la aparición de los tumores, promueven su recurrencia luego de la quimioterapia, y favorecen su metástasis a otros órganos”, recuerda el profesor Tapia. Y añade que “ahora esto se ha puesto mucho más interesante, ya que el efecto de la proteína súper estable ECE1c en la agresividad se repite en otras células cancerosas de distinto origen, como en glioblastoma –un tipo de cáncer cerebral- cuyos resultados están pronto a ser publicados en una revista internacional. Lo mismo pasa también en células de cáncer de pulmón”. “Y en aquel tiempo, supimos además dónde la CK2 fosforila a ECE1c, lo que es relevante para desarrollar posibles nuevas herramientas pronósticas y terapéuticas”.
Estos avances sentaron las bases de su actual proyecto Fondecyt 2022, en el que busca responder varias preguntas; entre otras, cómo es que este proceso de fosforilación se relaciona con una mayor estabilidad de la ECE1c y cómo esa súper estabilidad promueve que la célula se haga más agresiva. “Sabemos que CK2 está aumentada en muchos tipos de cáncer y ya conocemos dos sitios o aminoácidos en los que fosforila a ECE1c: si se pudiera detectar esa fosforilación en los tumores de pacientes tendríamos un marcador de mal pronóstico de la enfermedad. Y, con ello, se podría hacer una elección más racional de la terapia, pensar en una de mayor efectividad para ese paciente en particular, apuntando a una medicina personalizada”.
Pero no sólo establecer un biomarcador basado en esta proteína serviría de mucho; “eventualmente podríamos bloquear ese proceso de fosforilación mediante un inhibidor de la CK2 llamado silmitasertib –el que ya se ha usado en algunos estudios clínicos- provocando que la proteína ECE1c se degrade mucho más, que la célula cancerosa se haga menos agresiva y que muera más rápidamente. De hecho, otro tesista de doctorado, Eduardo Silva, encontró que ese mismo inhibidor provoca la regresión in vitro de los tumores de células de cáncer de colon”, agrega el académico.
Biomarcador de pronóstico y blanco terapéutico
Otro objetivo que propone el proyecto del profesor Tapia apunta a detallar aún más el mecanismo molecular de esa fosforilación: “hemos detectado que cuando sucede ese proceso una tercera proteína se une a la modificación que se produce en el sitio fosforilado. Esa proteína pertenece a un grupo conocido como 14-3-3 y son muy interesantes, porque se relacionan con muchas vías de transducción de señales. Nuestras células funcionan gracias a vías de transducción de señales intracelulares que se activan o se apagan; son como las carreras de posta, una proteína toca a la siguiente y la activa, y así sucesivamente, regulando de esa manera todos los procesos vitales”.
Entonces, añade, “estamos proponiendo que una proteína 14-3-3 activa a una vía de transducción de señales específica, la vía Wnt canónica, la cual se sabe está relacionada con la aparición de características troncales en distintas células. Esto explicaría cómo la célula cancerosa se hace más agresiva y resistente a las terapias”.
Este conocimiento cimentaría avances hacia la medicina personalizada en cáncer de colon, pues “junto a los colaboradores internacionales que tenemos en Inglaterra y España, proyectamos encontrar o generar moléculas pequeñas que impidan la interacción de las proteínas ECE1c fosforilada y 14-3-3, porque esperamos con eso que no se active la vía de señalización Wnt canónica y, por ende, la célula no adquiera características troncales ni se haga más agresiva”.
Y es que “conocemos las proteínas protagonistas, pero no tenemos una herramienta molecular que permita detectar esa fosforilación o bien impedir esa interacción. Por eso nuestra meta es desarrollar un aptámero –secuencia de ADN de cadena simple con una estructura tridimensional única que le permite unirse a un blanco específico con gran afinidad- que es como un anticuerpo pero químico, que funciona de manera similar a las vacunas al impedir la unión del virus a la célula; en este caso, son dos proteínas que al unirse generan agresividad en la célula de cáncer de colon: si se interviene con una molécula que imposibilite esa unión, entonces se evita que la célula se haga tan agresiva, por lo que el pronóstico de ese cáncer mejora”.
Así, finaliza, “ojalá pudiéramos encontrar la cura, pero sin duda un gran logro en investigación en cáncer es hacer que este sea crónico. Cuando sea como la diabetes o la hipertensión, va a ser un tremendo avance, y yo creo que para allá vamos con proyectos como este. La idea es evitar que el cáncer se vuelva agresivo; entonces, las tasas de muerte disminuirán notablemente”.