Todo parte con la proteína kinasa CK2, una enzima altamente conservada y presente en todas las células eucariotas estudiadas hasta el momento, cuya función es fosforilar –agregar una molécula de fosfato - a más de 300 proteínas dentro de la célula, lo que la involucra en numerosos procesos, tales como expresión de genes, síntesis de proteínas, división, desarrollo o muerte celular. Por ello, ha sido implicada en varias patologías que incluyen enfermedades infecciosas, degenerativas y el cáncer.
“En investigaciones previas en un modelo in vitro de cáncer colorrectal junto a quien fue mi tesista de doctorado Ignacio Niechi, actualmente académico de la Universidad Austral de Chile, encontramos que cuando CK2 fosforila a la enzima convertidora de endotelina-1c (ECE-1c) hace que esta no se degrade; por lo tanto, extiende por mucho su estabilidad y su vida útil. Pero lo que nos sorprendió fue que esta mayor estabilidad de la ECE-1c se relacionaba con un incremento de la agresividad, porque las células de cáncer de colon se hacían mucho más invasivas y también más resistentes a los quimioterapéuticos que habitualmente las matan, como es el 5-fluorouracilo, lo cual reportamos el 2020 en una publicación de mi tesista de doctorado Pablo Pérez en la revista Molecular Oncology”.
Estos importantes hallazgos se replicaron y corroboraron luego in vitro en células de glioblastoma, un tipo de cáncer cerebral, encabezados nuevamente por el doctor Tapia –en colaboración con el equipo del doctor Niechi en Valdivia- y fueron publicados el 2023 en la revista Cells. Más recientemente, estos resultados fueron también corroborados en células de cáncer de pulmón, cuyo primer investigador fue el tesista de magister Christopher Almarza, del mismo grupo investigador, y que apareció en la edición de octubre de la revista Biological Research.
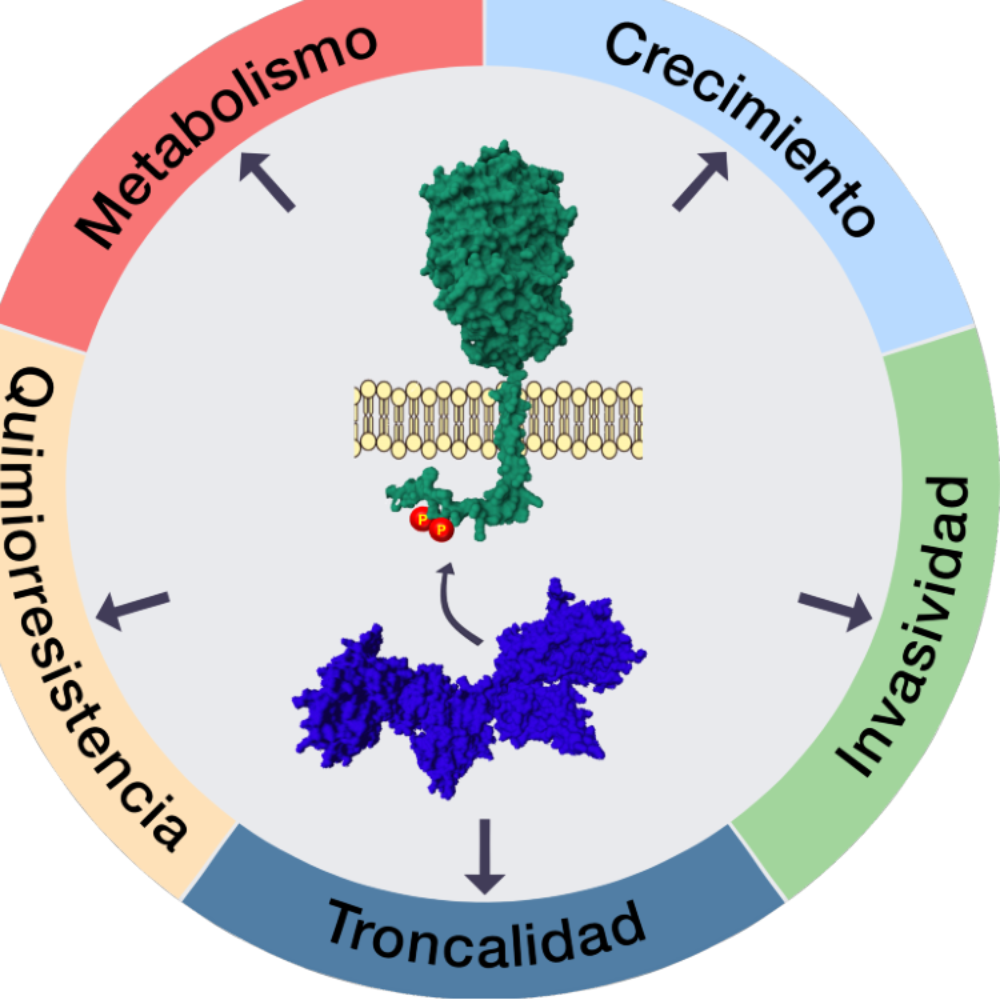
A lo largo de la misma línea de desarrollo, encontraron que cerca de donde se produce la fosforilación en ECE-1c hay un aminoácido, la lisina –responsable de su degradación- que si se reemplaza por una arginina, la proteína se vuelve súper estable y, si esta proteína alterada se expresa en células de cáncer colorrectal, estas se hacen más metastásicas y formadoras de tumores grandes en un modelo preclínico animal; es decir, se vuelven mucho más agresivas, lo que se debe a que adquieren cualidades de un tipo especial de células, conocidas como células troncales cancerosas.
“Identificamos en ECE-1c a otro aminoácido, la lisina, que aparentemente se bloqueaba producto de la fosforilación por CK2. En algunas proteínas las lisinas pueden sufrir una modificación que se llama poliubiquitinación – es decir, se le adhieren varias ubiquitinas, una pequeña proteína cuya función es regular la degradación de proteínas en las células-, lo que lleva a que el blanco desaparezca. Entonces detectamos que la fosforilación por CK2 impide que ocurra la ubiquitinación en la lisina, y por eso la proteína no se degrada”.
“Esto es muy sorprendente”, sentencia el doctor Tapia. “Que esta proteína tenga el mismo comportamiento o produzca los mismos efectos en tres cánceres distintos, es tremendamente relevante. Y solo nosotros estamos publicando que la ECE-1c, cuando está estable en la célula tumoral adquiere características troncales y, además, se hace muy agresiva”. Esta relevancia reside en que “se podría avanzar hacia utilizar a esta proteína cuando está fosforilada como un indicador de malignidad y, por ende, como un biomarcador de mal pronóstico en cáncer. Si llegamos a confirmar estos resultados a nivel de tejidos en biopsias, los médicos tratantes podrán determinar distintas estrategias terapéuticas dependiendo del nivel de este biomarcador. Por otro lado, también se podría considerar a ECE-1c como un potencial blanco terapéutico, porque hemos visto in vitro que cuando se inhibe a la proteína CK2 con una droga que se llama silmitasertib, y que ya se ha usado en algunos estudios clínicos, sucede que la proteína ECE-1c se degrada mucho más, lo que lleva a que la célula cancerosa se haga menos agresiva y que muera más rápidamente”, agrega.
¿Qué falta para hacer esa detección en tejido de cáncer?
“El gran problema es que no existe una forma simple de detectar esta proteína fosforilada en tejidos; no hay un anticuerpo, no hay una herramienta que pudieran usar los patólogos. Así que lo que estamos haciendo en nuestro laboratorio es avanzar en el desarrollo de anticuerpos químicos, que no son en realidad anticuerpos sino moléculas de ADN de simple hebra que se llaman aptámeros, y que se pueden hacer con la técnica de PCR. Ya tenemos un par, que estamos en vías de caracterizar y probar su capacidad de unión a la proteína fosforilada, porque ya tenemos resultados, pero contra una pequeña porción de la proteína, como es un péptido. Pero la idea es que ese aptámero detecte a la proteína fosforilada, y en su entorno celular, porque ese péptido podría no ser representativo de la proteína completa, que es mucho más grande. Para eso estoy colaborando con un colega del Programa de Biología Celular y Molecular del ICBM, doctor Assaf Katz, que es experto en interacciones proteína-ADN, para ver si el aptámero es capaz de detectar a la proteína fosforilada completa. De hecho, juntos vamos a dirigir la tesis de una alumna de la carrera de Tecnología Médica, quien va a caracterizar la unión específica del aptámero al péptido fosforilado in vitro. Pero más adelante nuestra idea es validar si el aptámero puede detectar a la proteína ECE-1c fosforilada en tejido de cáncer. ¡Será fantástico cuando eso pase!”, sentencia.