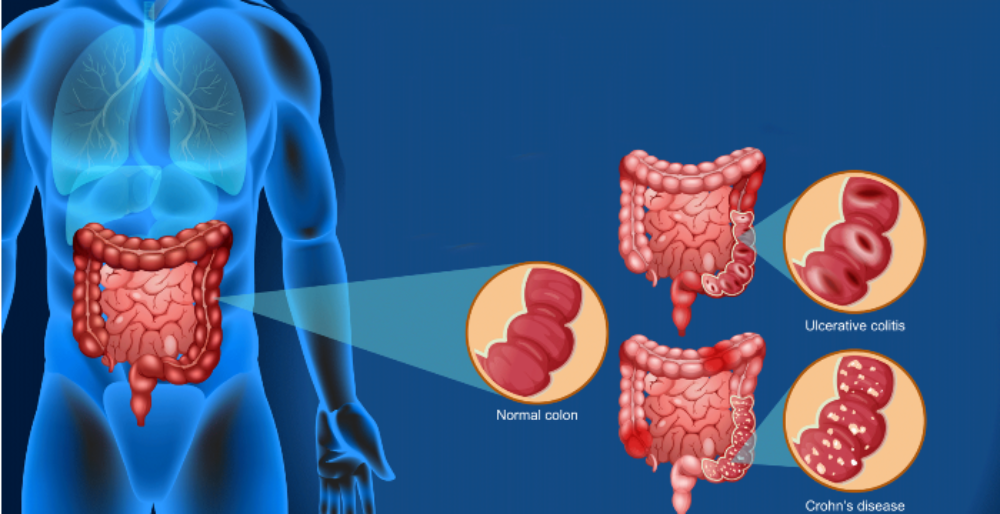
Según explica el investigador, magister en Microbiología y doctor en Ciencias Biomédicas de nuestro plantel, quien también encabezó el proyecto Fondef “Desarrollo de un consorcio bacteriano para el tratamiento de la disbiosis y la inflamación de la mucosa en la enfermedad inflamatoria intestinal”, en colaboración con el doctor Roberto Vidal, del mismo programa del ICBM, esta patología tiene dos entidades clínicas principales, como son la colitis ulcerosa y la enfermedad de Crohn.
“En términos generales, la enfermedad inflamatoria intestinal es multifactorial y todavía no se conoce muy bien la causa subyacente que gatilla su desarrollo, pero sí que participan factores genéticos, inmunológicos y ambientales, incluidos alteraciones en la microbiota intestinal; es decir, en las comunidades microbianas que habitan el intestino”, señala.
Y es que, pese a que pudiera parecer contradictorio, “en realidad el 99.9% de las bacterias son inocuas para el humano, incluso muchas son beneficiosas para nuestra fisiología; el funcionamiento normal de nuestro cuerpo no podría suceder en ausencia de microorganismos. En los últimos años ha tomado mucha más fuerza el estudio del microbioma humano; hoy sabemos que estas comunidades de microorganismos son necesarias y mantienen un equilibrio dinámico y una relación armoniosa con el hospedero. En esa interacción estimulan de forma favorable nuestro sistema inmune, incluso producen algunos metabolitos que son necesarios para el correcto funcionamiento del intestino. En quienes padecen enfermedad inflamatoria intestinal algunas comunidades de microorganismos se ven afectadas y disminuyen drásticamente, llegando en algunos casos hasta a desaparecer; y estas bacterias tienen funciones benéficas en términos antiinflamatorios”.
En el mencionado proyecto Fondef “apuntamos a generar un consorcio de estas bacterias para restablecerlas en el organismo de estos pacientes. Todavía estamos a nivel de prueba de concepto en modelo animal, y avanzando en ello”, dice el doctor Montero. Pero de ahí surgió la base de la actual investigación: “las Faecalibacterium conforman uno de los grupos de bacterias fundamentales, dado que tienen muchas propiedades antiinflamatorias descritas. Entonces, para profundizar en este microorganismo queremos conocer sus mecanismos moleculares; vamos a caracterizar algunas de sus cepas, para determinar cómo es la producción de sus metabolitos y el modo en que responden al estrés oxidativo, porque en los pacientes que tienen inflamación intestinal las concentraciones de oxígeno se alteran. Y es que el colon es básicamente anóxico, y las comunidades microbianas que viven allí, en su mayoría, son anaeróbicos estrictos, por lo que en presencia de oxígeno se ven afectados o mueren. Faecalibacterium es una bacteria extremadamente sensible al oxígeno, y en el intestino inflamado sus concentraciones aumentan, por lo que las dañan; entonces, queremos estudiar cómo las bacterias responden a este estrés y cómo se adaptan también”.
Conocer su biología, añade, permitirá generar información que esté en la base del desarrollo de un probiótico que tenga potencial antiinflamatorio, “para así poder seleccionar algunas de estas cepas que puedan administrarse de forma segura a los pacientes y cuya producción no sea tan difícil, porque hacer un cultivo bacteriano en ausencia de oxígeno es sumamente complejo desde el punto de vista del escalamiento de esa producción industrial. No es lo mismo que producir un lactobacillus, por ejemplo, que es el probiótico típico que se encuentra en la farmacia, porque son bacterias de muy fácil cultivo”.
¿Cómo llega esa bacteria al intestino?
Es algo que todavía no tiene respuesta. Sabemos que la colonización en los niños, comienza de forma bien posterior al nacimiento, y ya cerca de los tres años, la colonización es estable. En algunos estudios se ha reportado que dentro de la microbiota de la glándula mamaria y de la leche materna estaría presente Faecalibacterium; es una posible vía, entonces, por las cuales estaría llegando al intestino, pero la pregunta es ¿cómo llega a la glándula mamaria? No lo sabemos.
Dentro de esas mismas dudas, el doctor Montero señala que tampoco se sabe si la disbiosis intestinal, es decir la alteración de las comunidades microbianas, es la que genera el desencadenamiento de la inflamación; o, por el contrario, si es la propia inflamación la que afecta a las comunidades microbianas. “Hay estudios que apuntan a que hay ciertos microorganismos patógenos que podrían favorecer una inflamación crónica, como por ejemplo la Escherichia coli Adherente Invasiva”.
La enfermedad inflamatoria intestinal se trata a través de su sintomatología, mediante corticoides tópicos y orales; “lo que se busca es inducir un periodo de remisión de la enfermedad, donde la persona disminuye sus síntomas típicos tanto en Crohn como en colitis ulcerosa, para que se mantengan un tiempo en remisión”
¿Se espera que en esos periodos de remisión Faecalibacterium recupere su nivel?
De hecho, hay estudios en el tiempo que siguen a cohortes de pacientes con enfermedad inflamatoria intestinal, donde demuestran que durante los periodos de actividad de la enfermedad esas comunidades microbianas se afectan, y después, en los periodos de remisión, hay una recuperación parcial de esas comunidades microbianas, incluido Faecalibacterium. Entonces, dentro de los objetivos que tenemos, más específicamente para el Fondef, es que nuestros consorcios de bacterias no solamente sean terapéuticos, sino también profilácticos, para extender el periodo de remisión.
“Ahora, esto no sería una cura, sino un tratamiento complementario al farmacológico estándar que se administra a estos pacientes. Nuestra hipótesis es que una vez que se induzca la remisión mediante fármacos, si estas personas continúan con un suplemento de estos probióticos, el periodo de remisión podría eventualmente extenderse para evitar una reactividad de la enfermedad a corto plazo. Eso es algo que está por demostrarse, pero es algo que vamos a investigar más adelante”.
¿Esto se podría lograr mediante trasplantes fecales?
Los trasplantes fecales se han explorado para varias enfermedades, y por ejemplo de forma muy exitosa para infecciones crónicas por Clostridium difficile y para otras patologías. Y en el caso de la enfermedad inflamatoria intestinal, se ha experimentado y hecho estudios clínicos con trasplantes de microbiota fecal en cohortes grandes de pacientes, con resultados mixtos, porque hay muchos factores y variables que inciden: por ejemplo, que las heces fecales que se utilizan de los donantes cambian todo el tiempo; no es siempre la misma persona, o incluso si lo fuese, no es la misma microbiota. Además, dentro de ese trasplante de microbiota, van cientos de microorganismos distintos, y probablemente sólo algunos de ellos tendrán efectos beneficiosos y eso, desde el punto de vista de bioseguridad, es complejo porque se podría transferir un patógeno. Por eso es que lo que nosotros buscamos con el consorcio de bacterias es complementar el tratamiento farmacológico estándar que se administra a estos pacientes, mediante algunos de esos microorganismos que son los que generan este efecto beneficioso. Si logramos su caracterización y cultivo de manera exitosa podríamos administrarlos de manera segura.
Para el desarrollo del proyecto se basarán en un cepario de bacterias en el que han aislado Faecalibacterium tanto de individuos sanos como de pacientes con enfermedad inflamatoria intestinal; posteriormente secuenciarán su genoma, para luego analizar las redes metabólicas de ese genoma y así saber qué metabolitos producen. “Y haremos estudios de transcriptómica, en los que estas cepas serán sometidas a estrés oxidativo, para ver su respuesta y posibles adaptaciones”, señala el doctor Montero. Finalmente, en modelos in vitro y eventualmente también en animales, estudiarán las propiedades probióticas de algunas de esas cepas, de modo de determinar cuáles podrían ser seleccionadas para futuros ensayos.